化学选修3:晶体的常识
本章的核心是区分晶体与非晶体,并理解晶体的内部结构决定其外部性质。
晶体与非晶体
| 特征 | 晶体 | 非晶体 |
|---|---|---|
| 定义 | 内部微粒(原子、分子、离子)在三维空间里呈周期性有序排列构成的固体。 | 内部微粒排列呈现无序状态的固体,也叫无定形体。 |
| 自范性 | 有,能自发地呈现多面体几何外形。 | 无,没有规则的几何外形。 |
| 各向异性 | 有,物理性质(如光学、导热、导电、机械强度等)在不同方向上表现出差异。 | 无,物理性质在各个方向上都是相同的,是各向同性的。 |
| 固定熔点 | 有,有固定的、确定的熔化温度。 | 无,没有固定的熔点,只有一个软化温度范围。 |
| 实例 | 食盐、水晶、金刚石、冰、金属 | 玻璃、沥青、石蜡、松香、橡胶 |
晶胞
晶胞是描述晶体结构的基本单元,是晶体中最小的结构重复单元,整个晶体可以看作是无数个晶胞在空间上平行排列、无限延伸而得到的。
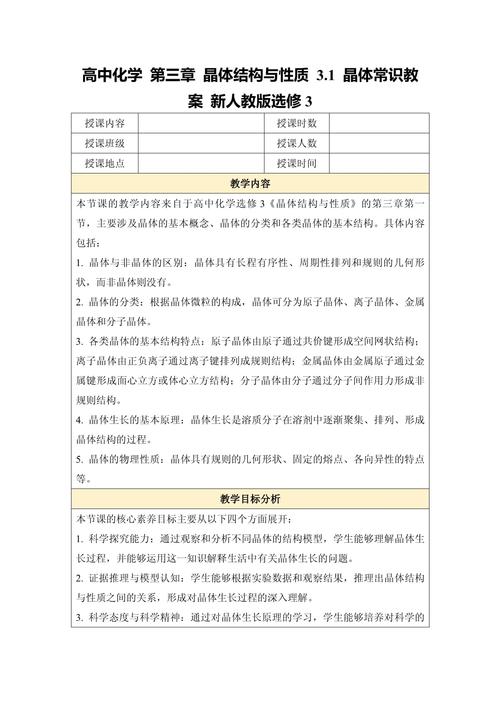
晶胞的特征:
- 代表性:晶胞的形状和大小代表了整个晶体的宏观外形和晶格参数。
- 最小性:是能完整反映晶体结构特征的最小单元。
- 周期性:晶胞在空间中平移、旋转可以重构整个晶体。
晶胞的两种堆积方式:
这是本章的重点和难点,也是区分不同晶体类型的关键。
| 堆积方式 | 非密置层堆积 | 密置层堆积 |
|---|---|---|
| 描述 | 原子位于正方形的四个顶点,层内原子间非接触,有较大空隙。 | 原子呈蜂巢状紧密排列,层内原子相互接触,空隙最小。 |
| 堆积类型 | 简单立方 (一层) |
六方最密 (ABAB...) 面心立方 (ABCABC...) |
| 空间利用率 | 较低 (52%) | 高 (74%) |
| 配位数 | 6 | 12 |
| 实例 | Po(钋)(纯理论,实际罕见) | Mg, Zn, Ti (六方最密) Cu, Ag, Au, Al (面心立方) |
关键点:
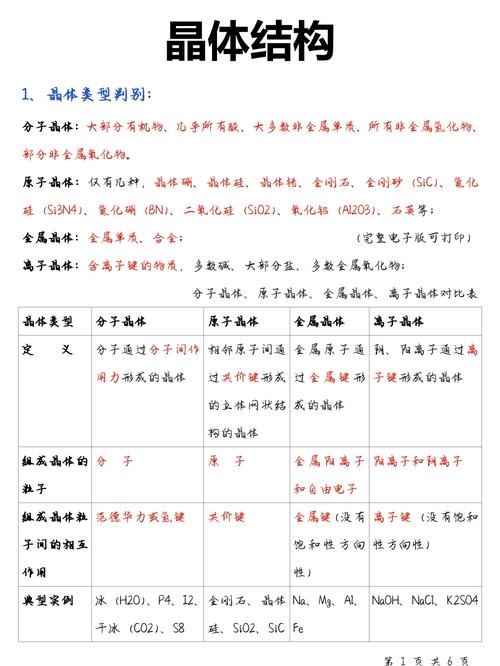
- 配位数:在晶体结构中,一个微粒周围最邻近的微粒的数目。
- 空间利用率:晶胞中原子(或分子等)自身所占体积与整个晶胞体积的百分比。
- 六方最密堆积和面心立方最密堆积是空间利用率最高的两种堆积方式,都是74%。
四种基本晶体类型
根据构成晶体的微粒种类和微粒间作用力的不同,晶体可以分为四种基本类型,这是本章的核心内容,需要从构成微粒、微粒间作用力、性质三个方面进行对比记忆。
| 晶体类型 | 离子晶体 | 原子晶体 | 分子晶体 | 金属晶体 |
|---|---|---|---|---|
| 构成微粒 | 阴、阳离子 | 原子 | 分子(极性/非极性) | 金属阳离子和自由电子 |
| 微粒间作用力 | 离子键(强) | 共价键(极强) | 分子间作用力(范德华力、氢键) | 金属键 |
| 熔沸点 | 较高(如 NaCl 801°C) | 非常高(如金刚石 > 3550°C) | 较低(如干冰 -78.5°C 升华) | 一般较高,差异大(如 W 3410°C,Hg -39°C) |
| 硬度 | 较硬,脆 | 硬度大,脆 | 较小,软 | 一般较大,有延展性 |
| 导电性 | 固态不导电,熔融或水溶液导电 | 不导电(除Si等半导体) | 不导电(除一些极性分子在水中电离) | 良好导电 |
| 溶解性 | 一般易溶于水,难溶于有机溶剂 | 一般不溶于任何溶剂 | 相似相溶(极性分子易溶于极性溶剂) | 一般不溶于常见溶剂 |
| 实例 | NaCl, CsCl, CaO | 金刚石、晶体硅、SiO₂(石英)、SiC | 冰(H₂O)、干冰(CO₂)、I₂、P₄ | Fe, Cu, Na, W, 合金 |
典型晶体的结构分析(重点模型)
NaCl型(面心立方晶胞)
- 晶胞构成:一个Na⁺周围有6个Cl⁻,一个Cl⁻周围有6个Na⁺。
- 晶胞中的微粒数:
- Na⁺:位于棱心和体心,数量为 $12 \times \frac{1}{4} + 1 = 4$ 个
- Cl⁻:位于顶点和面心,数量为 $8 \times \frac{1}{8} + 6 \times \frac{1}{2} = 4$ 个
- 化学式:NaCl (阴阳离子个数比为1:1)
CsCl型(简单立方晶胞)
- 晶胞构成:一个Cs⁺周围有8个Cl⁻,一个Cl⁻周围有8个Cs⁺。
- 晶胞中的微粒数:
- Cs⁺:位于体心,数量为1个
- Cl⁻:位于顶点,数量为 $8 \times \frac{1}{8} = 1$ 个
- 化学式:CsCl (阴阳离子个数比为1:1)
干冰(CO₂)型(面心立方晶胞)
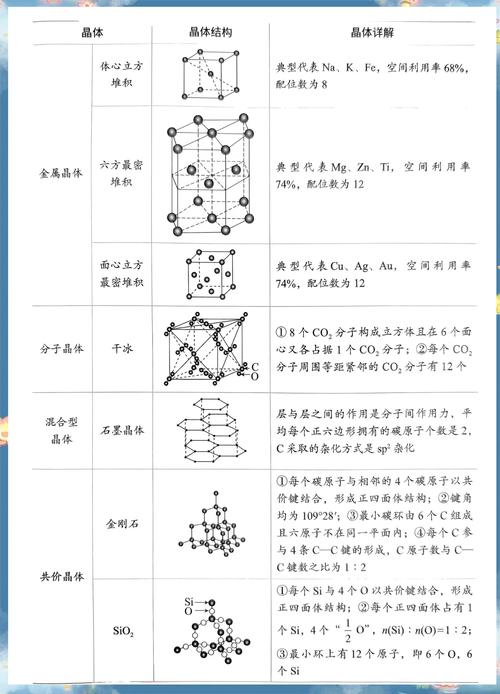
- 晶胞构成:CO₂分子位于晶胞的顶点和面心。
- 晶胞中的微粒数:
CO₂分子:数量为 $8 \times \frac{1}{8} + 6 \times \frac{1}{2} = 4$ 个
- 化学式:CO₂
金刚石型(面心立方晶胞)
- 晶胞构成:每个碳原子与周围的4个碳原子形成共价键,构成正四面体结构。
- 晶胞中的微粒数:
C原子:位于顶点、面心和内部,数量为 $8 \times \frac{1}{8} + 6 \times \frac{1}{2} + 4 = 8$ 个
- 化学式:C
石墨型
- 结构特点:层状结构,层内碳原子以共价键结合,形成平面六元环网状结构;层间以分子间作用力结合。
- 性质体现:层内作用力强,所以熔点高;层间作用力弱,所以质软,可以做润滑剂和电极材料(能导电)。
晶体结构的计算(核心考点)
晶胞中微粒数的计算方法
- 顶点:被8个晶胞共用,每个晶胞占 $\frac{1}{8}$。
- 棱:被4个晶胞共用,每个晶胞占 $\frac{1}{4}$。
- 面:被2个晶胞共用,每个晶胞占 $\frac{1}{2}$。
- 体心:完全属于该晶胞,占1个。
密度(ρ)的计算公式 $$ \rho = \frac{Z \times M}{N_A \times a^3} $$
- $Z$:一个晶胞中包含的微粒(原子、分子、离子等)的数目。
- $M$:微粒的摩尔质量(单位:g/mol)。
- $N_A$:阿伏加德罗常数,$6.02 \times 10^{23} \text{ mol}^{-1}$。
- $a$:晶胞的边长(单位:cm),如果题目给出的是pm,需要换算成cm ($1 \text{ pm} = 10^{-10} \text{ cm}$)。
- $a^3$:晶胞的体积(单位:cm³)。
晶胞中空间利用率的计算 $$ \text{空间利用率} = \frac{\text{晶胞中所有原子的体积}}{\text{晶胞的体积}} \times 100\% $$
总结与学习建议
- 抓主线:以“晶体 vs 非晶体”为开篇,引出晶体的核心特征(自范性、各向异性、固定熔点)。
- 建模型:以“晶胞”为基本模型,理解晶体结构的微观描述。
- 分类比:掌握“四种晶体类型”的对比,这是判断物质性质的基础,牢记构成微粒和作用力是决定晶体类型和性质的根源。
- 破难点:重点攻克“晶胞计算”,特别是微粒数的计算和密度的计算公式,这是高考的必考点。
- 多联想:将抽象的晶体结构与宏观物质性质联系起来,为什么金刚石那么硬?因为内部是牢固的共价网状结构,为什么金属能导电?因为有自由电子。
希望这份梳理能帮助你清晰地掌握“晶体的常识”这一章节的内容!